Entenda como funciona a terapia Car-T, que pode revolucionar o tratamento contra o câncer
Um tratamento que custa até R$ 3 milhões por paciente pode parecer inviável à primeira vista. Mas, no caso da terapia celular CAR-T, o investimento inicial elevado pode representar economia a longo prazo e melhores chances de cura.
É o que mostra um estudo liderado pelo médico Samir Nabhan, supervisor da Unidade de Transplante de Medula Óssea, Oncologia e Hematologia do Complexo Hospital de Clínicas da Universidade Federal do Paraná (UFPR), apresentado nesta semana no Congresso Brasileiro de Hematologia, Hemoterapia e Terapia Celular.
Publicada no “Journal of Medical Economics”, a pesquisa analisou o impacto clínico e financeiro do uso dessa tecnologia em pacientes com linfoma difuso de grandes células B, o tipo mais comum e agressivo de linfoma não Hodgkin.
Apesar dos resultados promissores, o tratamento ainda não está disponível no Sistema Único de Saúde (SUS). No Brasil, ele é oferecido apenas em centros privados autorizados, e os custos são arcados por planos de saúde ou recursos particulares.
“Essas terapias são caras, mas se você usa precocemente, evita gastar ainda mais nas terapias subsequentes”, explica Nabhan ao g1. “Cada recidiva encarece o tratamento e reduz as chances de cura.”
Car-T Cell: entenda terapia celular contra câncer aplicada de forma experimental
Editoria de Arte/g1
O que são as ‘linhas’ de tratamento
Na oncologia, as linhas de tratamento indicam a ordem em que os pacientes recebem as terapias conforme a doença progride.
A primeira linha é o tratamento inicial — no caso desse linfoma, a combinação de quimioterapia e imunoterapia conhecida como R-CHOP.
Se o câncer volta, vem a segunda linha, geralmente com quimioterapia mais intensa ou transplante autólogo de medula.
Quando há nova recidiva, entra a terceira linha, onde se concentram as terapias mais modernas, como a CAR-T ou os anticorpos biespecíficos.
Essas etapas são decisivas porque cada recidiva encarece o cuidado e reduz a taxa de cura. É nesse ponto que o estudo de Nabhan inverte o raciocínio tradicional: quanto mais cedo se usa a terapia cara, menor o custo total no fim.
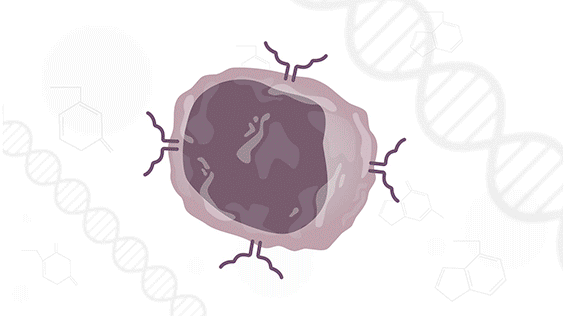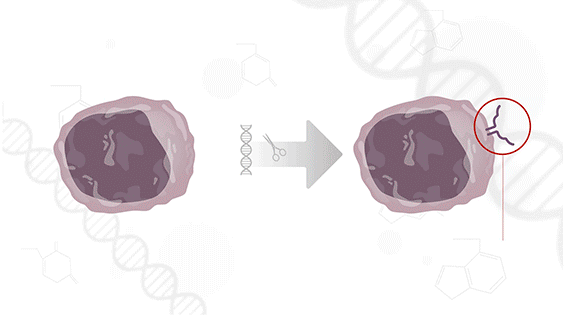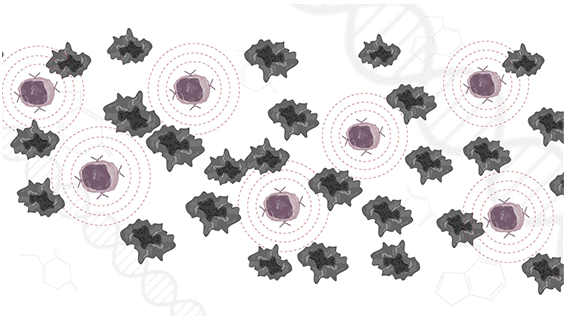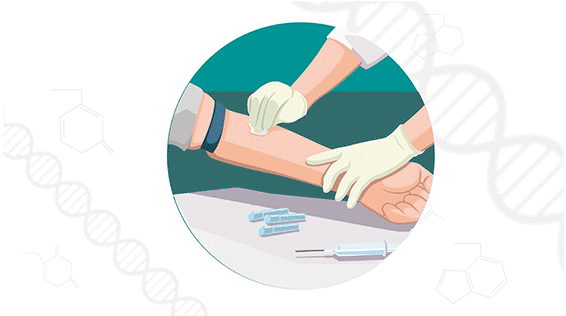
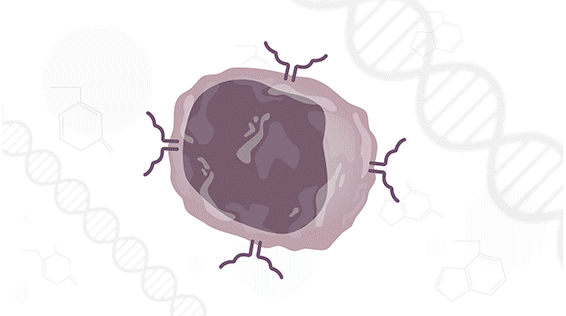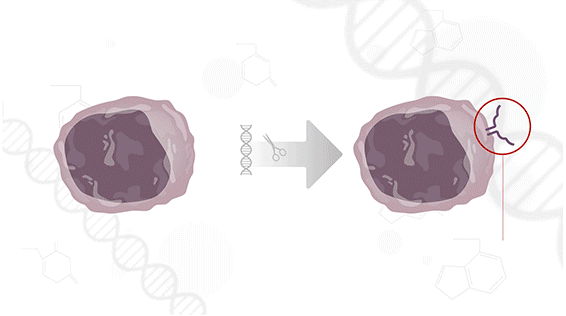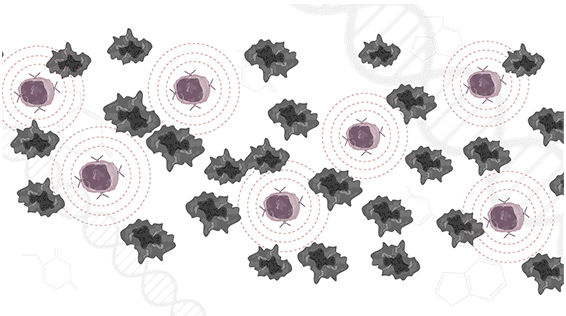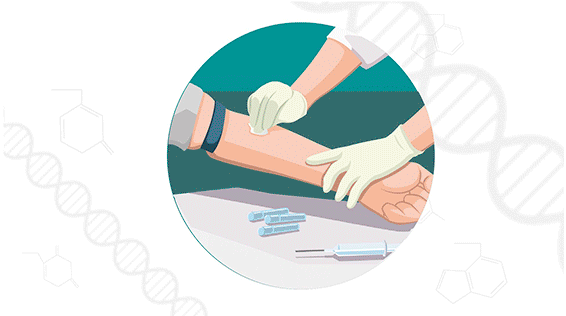
Como funciona a CAR-T
A terapia celular CAR-T é uma forma avançada de imunoterapia personalizada. As células de defesa do paciente (linfócitos T) são retiradas do sangue, modificadas geneticamente em laboratório — fora do Brasil — para reconhecer e atacar o tumor, e depois reinfundidas no corpo.
“É como se as células ganhassem um novo receptor, uma espécie de chave para encontrar e destruir as células doentes”, explica a médica Ana Rita Fonseca, coordenadora do Centro de Terapias Avançadas do Hospital Sírio-Libanês.
A tecnologia está aprovada no Brasil pela Agência Nacional de Vigilância Sanitária (Anvisa) para tratar linfomas e leucemias que não respondem a terapias anteriores. As versões disponíveis são o axi-cel (axicabtagene ciloleucel), o tisa-cel (tisagenlecleucel) e o cilta-cel (ciltacabtagene autoleucel, usado em mieloma múltiplo).
car-t
Hemocentro de Ribeirão Preto (USP)/arte g1
Quando o caro sai mais barato
O trabalho comparou o desempenho clínico e financeiro da CAR-T com outros tratamentos já usados no país, como o epcoritamab (anticorpo biespecífico) e as terapias convencionais de quimio e transplante.
Mesmo custando mais no início, a CAR-T mostrou melhor custo-benefício quando usada mais cedo — especialmente na segunda e terceira linha de tratamento.
Os resultados:
Aplicar a CAR-T antes do epcoritamab gerou economia média de R$ 194 mil por paciente.
Quando usada ainda mais cedo, na segunda linha, a economia estimada chegou a R$ 1,3 milhão.
Além disso, menos pacientes precisaram de novas terapias, o que significa menos internações e menor gasto global.
“Investir cedo traz retorno econômico e clínico”, diz Nabhan. “É o tipo de decisão que se paga com o tempo.”
Exame de paciente mostra antes e depois da aplicação da terapia CAR-T Cell Hemocentro Ribeirão Preto, SP
Divulgação
A realidade brasileira
O estudo é o primeiro do tipo adaptado à estrutura de custos da saúde privada brasileira, que tem múltiplos pagadores e variações de preço entre estados e operadoras.
“O mesmo medicamento pode ter valores diferentes dependendo do convênio e do hospital”, explica Nabhan. “Tentamos refletir essa diversidade, porque o Brasil não tem uma única tabela de custos.”
A simulação considerou dados da Câmara de Regulação do Mercado de Medicamentos (CMED) e da Classificação Brasileira Hierarquizada de Procedimentos Médicos (CBHPM).
Segundo o médico, o modelo também mostra que usar a CAR-T mais tarde gera um efeito cascata de despesas: cada recidiva exige internações, novas drogas e mais tempo de hospital. “É como um investimento: quanto mais cedo você aplica, maior o retorno”, resume.
Impacto clínico: mais vidas salvas
Antes da chegada da CAR-T, as taxas de cura para o linfoma difuso de grandes células B recidivado não passavam de 20%.
Com a nova terapia, os índices de cura e sobrevida sobem para 50% a 60% em dois anos, segundo o levantamento.
“Estamos curando de 30% a 40% a mais de pacientes. É uma mudança real no destino dessas pessoas”, afirma Nabhan.
Desafios e próximos passos
Apesar dos avanços, o custo e a infraestrutura continuam sendo barreiras. O tratamento depende de centros altamente especializados e de uma cadeia internacional de produção, o que encarece o processo e limita o acesso.
Pesquisas da Fundação Oswaldo Cruz (Fiocruz) e do Instituto Butantan buscam desenvolver versões nacionais da tecnologia, o que poderia reduzir custos e ampliar o acesso.
“A dependência externa encarece. Produzir etapas no Brasil pode mudar isso”, afirma o oncologista Stephen Stefani, do grupo Oncoclínicas e da Americas Health Foundation.
Para Nabhan, o futuro da oncologia passa por enxergar valor além do preço:
“A terapia é cara, mas custo-efetiva. Precisamos olhar o impacto global — menos recividas, mais cura e mais tempo de vida.”